|
具有力学感知的全自动单细胞注射技术
——活体全自动单细胞注射的最新解决方案
微量细胞注射自从70 年代问世一直以来,就成为蛋白、核酸、多肽、药物、微粒子等进入细胞的重要手段。但是该技术对于操作者的要求过高,用于注射的显微注射针难以制备又成为了它难以广泛应用的技术壁垒。现如今FluidFM技术的出现,攻克了这一技术壁垒。
FluidFM是AFM与微流控技术的完美结合的产物
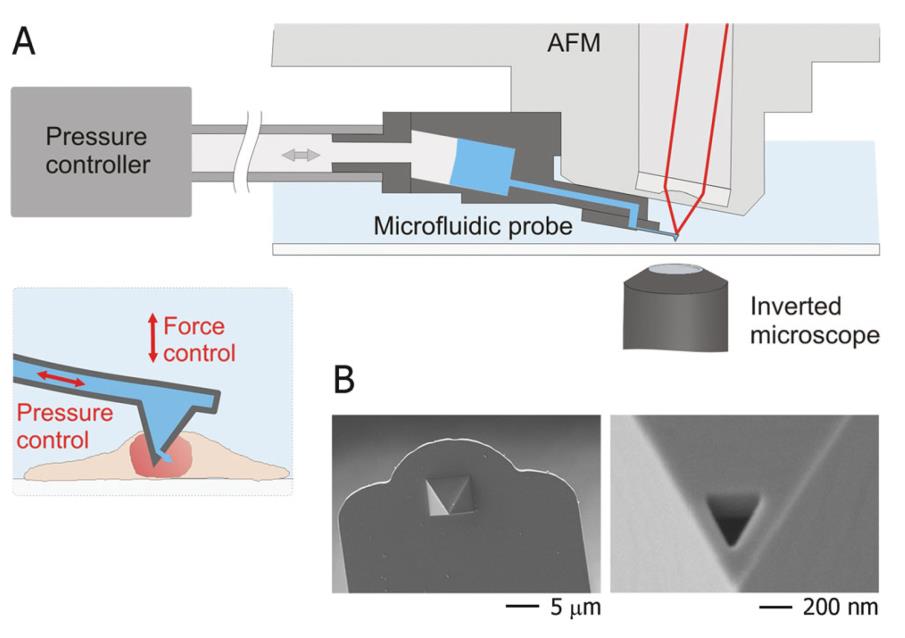
最新型的纳米技术让微流控注射技术有了新的转机。通过纳米工艺技术所制造出的中空纳米探针,使得探针在进行表面力学探测的同时具有了向探测物体注射的能力。这种特点使得这种探头能够感知细胞表面应力,给了用户对探针当前状态最直接的感官,能够帮助使用者快速了解探针目前状态,判断注入时机。而完美的与微流控结合也让注射精度得到了完美的控制。另外使用的纳米探针十分微小,注射器头部仅有400 nm,几乎不会对细胞造成损伤。
全自动、高效率的U2OS细胞注射的动态演示
FluidFM 如何工作?
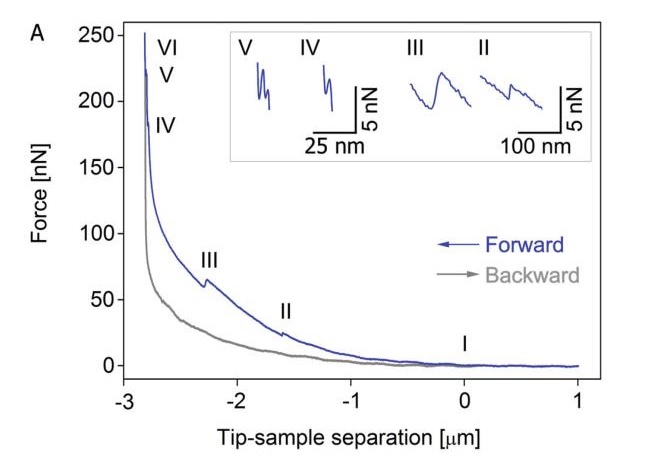
当注射器在刺破细胞膜或者核膜的时候就会产生力学的变化。具备力学探测功能的FluidFM系统就能够在力谱中探测到这种力学的变化。
如图中A中(I)力学曲线开始上升,说明探针与细胞表面开始接触。(II)当注射器刺破细胞膜之后,探针表面的阻力立即降低。因此我们就可以在图中观测到第一个松弛峰。(III)随后当探针继续深入就会与核解除并且刺破核膜这时候我们就会观察到第二个松弛峰。(IV)当探针继续下移,开始靠近载玻片后,压力开始快速增大,直到核膜刺破。(V)之后随着探针的继续深入,细胞膜也被穿透。(VI)这时候探针与玻璃完全接触,作用力随着Z轴下移直线增加。
FluidFM的注射精度极高
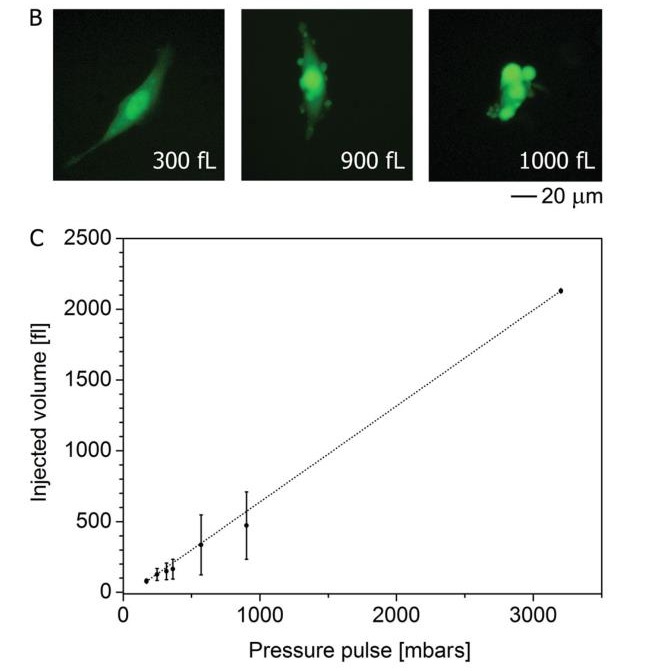
使用FluidFM技术进行细胞注射是一种十分快捷可靠的手段。首先对单个细胞注射量进行考量结果如b所示。在注射800fL(相当于20%的细胞总体积)时,没有观测到任何细胞形态上的改变。而在注射体积达到900fL后,细胞表面开始出现小泡。进而继续增加注射体积,则细胞形态发生改变。而后对重复注射,注射量的考察中对超过30个细胞的注射体积进行了统计(表C)。从结果上看在进行小于500 mbar的压力注射时,注射体积的线性,稳定性极好,具有良好的重复性。
使用FluidFM进行注射不会影响细胞活力
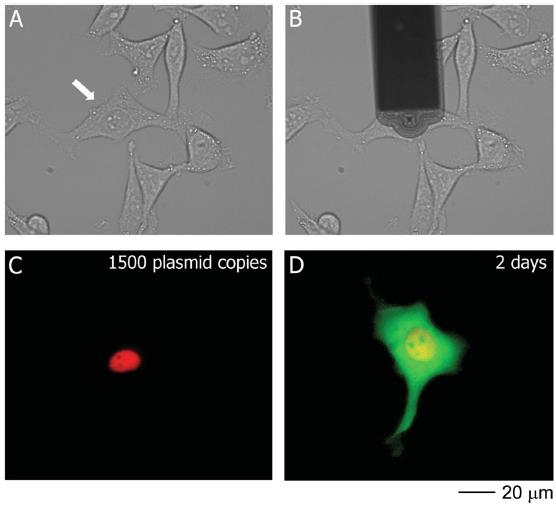
随后为了考察FluidFM对细胞活力的影响,研究者选择将pmaxGFP与RFP荧光染料混合注入细胞核。由于注射物中含有RFP染料,因此可以立刻监视注射位置。结果显示FluidFM准确地将染料与质粒转入了细胞核,没有任何染料流入细胞质。随后在两小时观察时即可看到GFP荧光蛋白的表达,并在17小时后达到峰值。多功能单细胞显微操作系统—FluidFM BOT,是将原子力系统、微流控系统、细胞培养系统为一体的单细胞操作系统。主要功能包括单细胞注射、单细胞提取以及单细胞分离。
FluidFM BOT 极大的方便了单细胞水平的研究,尤其适合应用于精准医疗、单细胞生物学、单细胞质谱、单细胞基因编辑、药物研发等领域。
总结
简单的操作,精准的注射,让FluidFM技术在显微注射领域独具魅力。这种强大的工具日后定将在常规和特种注射领域大放光彩。
瑞士Cytosurge 多功能单细胞显微操作系统 FluidFM BOT
——注射、提取、分选一体化的单细胞操纵解决方案

多功能单细胞显微操作系统—FluidFM BOT,是将原子力系统、微流控系统、细胞培养系统为一体的单细胞操作系统。主要功能包括单细胞注射、单细胞提取以及单细胞分离。
FluidFM BOT 极大的方便了单细胞水平的研究,尤其适合应用于精准医疗、单细胞生物学、单细胞质谱、单细胞基因编辑、药物研发等领域。
参考文献
[1] C. Mueller , A. Graessmann , M. Graessmann , Trends Biochem. Sci1980 , 5 , 60 .
[2] Y. Zhang , L.-C. Yu , Curr. Opin. Biotechnol. 2008 , 19 , 506 .
[3] P. Candeloro , L. Tirinato , N. Malara , A. Fregola , E. Casals ,V. Puntes , G. Perozziello , F. Gentile , M. L. Coluccio , G. Das ,C. Liberale , F. De Angelis , E.
Di Fabrizio , Analyst 2011 , 136 ,4402 .
[4] A. Dorr , V. Kiermer , A. Pedal , H.-R. Rackwitz , P. Henklein ,U. Schubert , M.-M. Zhou , E. Verdin , M. Ott , EMBO J. 2002 , 21 ,2715 .
[5] M. Rechsteiner , L. Kuehl , Cell 1979 , 16 , 901 .
[6] C. Lappe-Siefke , C. Maas , M. Kneussel , J. Neurosci. Methods2008 , 175 , 88
[7] W. W. Franke , E. Schmid , S. Mittnacht , C. Grund , J. Jorcano , Cell1984 , 36 , 813 .
[8] R. B. Silver , Dev. Biol. 1989 , 131 , 11 .
[9] M. P. King , G. Attardi , Cell 1988 , 52 , 811 .
[10] M. R. Capecchi , Cell 1980 , 22 , 479 .
[11] C. M. Cuerrier , R. Lebel , M. Grandbois , Biochem. Biophys. Res.Commun. 2007 , 355 , 632 .
[12] O. Loh , R. Lam , M. Chen , N. Moldovan , H. Huang , D. Ho ,H. D. Espinosa , Small 2009 , 5 , 1667 .
[13] K. Yum , N. Wang , M.-F. Yu , Nanoscale 2010 , 2 , 363 .
[14] S. Han , C. Nakamura , I. Obataya , N. Nakamura , J. Miyake ,Biochem. Biophys. Res. Commun. 2005 , 332 , 633 .
[15] S.-W. Han , C. Nakamura , N. Kotobuki , I. Obataya , H. Ohgushi ,T. Nagamune , J. Miyake , Nanomed. Nanotech. Biol. Med. 2008 , 4 ,215 .
[16] G. S. Michael , M. F. Erica , L. Z. Barry , H. B. Haim , Nanotechnology2008 , 19 , 015101 .
[17] X. Chen , A. Kis , A. Zettl , C. R. Bertozzi , Proc. Natl. Acad. Sci. USA2007 , 104 , 8218 .
[18] A. Meister , M. Gabi , P. Behr , P. Studer , J. Vörös , P. Niedermann ,J. Bitterli , J. Polesel-Maris , M. Liley , H. Heinzelmann , T. Zambelli, Nano Lett. 2009 , 9 ,
2501 – 2507 .
[19] M. Yokokawa , K. Takeyasu , S. H. Yoshimura , J. Microsc. 2008 , 232 , 82.
[20] G. Minaschek , J. Bereiterhahn , G. Bertholdt , Exp. Cell Res. 1989 ,183 , 434 .
[21] G. M. Lee , J. Cell Sci. 1989 , 94 , 443 .
[22] D. Schindelhauer , A. Laner , Gene Ther. 2002 , 9 , 727 .
|






