CAR/TCR拷贝数检测概念
CAR-T和TCR-T都属于比较主流的特异性免疫细胞治疗,且细胞来源相同,均来自外周血单核细胞(PBMC)、自体或同种异体细胞。
CAR-T细胞疗法的作用机制是利用慢病毒(LV)等作为递送载体,将CAR基因序列转移到T细胞基因组,使T细胞特异性识别并结合肿瘤细胞,然后通过释放穿孔素等因子杀伤肿瘤细胞,从而达到治疗目的。其具有杀肿瘤效果好、治疗效果持久、适用高龄人群也适宜联合用药等优势。
TCR-T细胞疗法的作用机制是先从患者血液或肿瘤组织中分离出T细胞,然后从单个T细胞克隆中分离出TCRα和β链,并插入慢病毒或逆转录病毒载体中,再进行病毒转染T细胞,将目标TCRαβ序列引入T细胞中,获得能够特异性识别肿瘤抗原的TCR-T细胞,这些经过修饰的T细胞随后在体外扩增,以获得足够的数量用于治疗和重新输回患者体内。TCR-T疗法具有较强的靶向性、渗透性和稳定性等优势。
但这两种疗法都将目的基因构建到慢病毒或逆转录病毒载体中,然后进行病毒感染T细胞,获得CAR-T或TCR-T细胞。这些载体基因整合在T细胞基因组中,一方面显示有T细胞进行了CAR或TCR基因修饰,一方面又是一个安全性指标,可能会因整合而带来原癌基因的激活或抑癌基因的失活等造成二次肿瘤的风险。尽管现在载体的设计已经大大降低了整合的风险,但这种风险仍未完全消除,因此需要对整合到细胞基因组中的病毒载体拷贝数进行检测。
法规监管要求
针对CAR和TCR基因整合带来的潜在风险,国内外的药品监管相关机构都发布了相应的指导性文件。
2018年6月,中国食品药品检定研究院颁发的《CAR-T细胞治疗产品质量控制检测研究及非临床研究考虑要点》明确规定CAR基因拷贝数≤5 copies/细胞。
国家药品监督管理局于2021年发布的《免疫细胞治疗产品临床试验技术指导原则(试行)》指导原则也有提及:对于经过基因修饰的免疫细胞治疗产品如CAR-T,采用实时荧光定量聚合酶链式反应(qPCR)和流式细胞术(Flowcytometry)进行PK分析,分别通过测定外源基因拷贝和CAR+细胞数量的变化,有助于互相验证检测方法的可靠性,可以更全面的分析产品在体内的扩增和存活情况。
FDA相关的指导原则是2022年发布的《Considerations for the Development of Chimeric Antigen Receptor (CAR) T Cell Products, Draft Guidance for Industry》指南草案,提到:在临床阶段,推荐采用根据体重或体表面积计算的CAR-T细胞数来确定剂量水平,在对PK的研究中,CAR-T细胞在人体样本(如血液和骨髓)中的扩增和持续,可通过收集特定时间点的样本来测定。推荐含足够采样时间点,尤其是在扩增期,即约为给药后两周左右,方法可采用检测CAR基因拷贝数和CAR的表达。
检测方法的选择
在CAR-T细胞的药代动力学(PK)评估中,CAR阳性率作为CAR-T细胞产品活性的关键特征,其数量和比例尤为重要。目前,CAR阳性率的检测方法主要有:流式细胞术、抗药抗体(ADA)检测、分子生物学水平检测等方法。
不同于流式细胞术、抗药抗体检测等方法是靶向CAR-T细胞的比例进行检测,分子生物学检测CAR阳性率的过程是基于CAR结构酶切位点的前后两端序列和CAR胞内结构域等序列来源作为引物的设计模板,在分子水平上测定CAR分子的基因序列,从而鉴定和确认目标CAR结构转染基因拷贝数。该方法的优势在于可以轻松提供有关扩增和动力学的量化基因组水平信息,甚至可以检测外周血中极少量的CAR-T细胞。
目前,实时荧光定量PCR(qPCR)广泛用于CAR和TCR等转基因拷贝数的检测中。
CAR/TCR基因拷贝数的检测,主要包括CAR-T或TCR-T细胞悬液收获阶段和接受CAR-T或TCR-T细胞治疗的患者定期取外周血随访监测阶段。
针对上述情况,翌圣生物自主研发了CAR/TCR基因拷贝数检测试剂盒,采用多重荧光探针qPCR法分别检测CAR-T或TCR-T细胞基因组中CAR或TCR基因的拷贝数以及人体细胞中单拷贝基因(Single Copy Gene, SCG)。还研发了与之配套使用的宿主细胞残留DNA样本前处理试剂盒,以及配套的自动化核酸提取仪器。
下图就CAR/TCR基因拷贝数检测工作流程,进行了详细介绍:
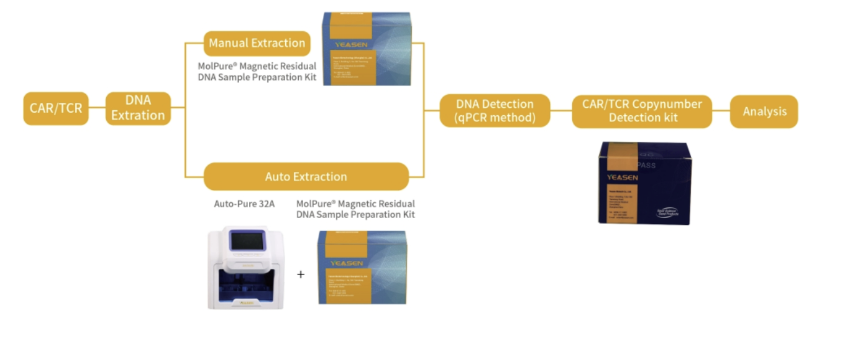
CAR/TCR基因拷贝数检测Kit产品性能
符合法规:按照法规要求进行全面验证,可提供验证报告;
保障品质:试剂盒原材料全自主研发,qPCR Mix等酶产品在超洁净酶工厂生产;
灵敏度高:检测限可达1.05copies/μL;
精密度高:批内重复性高,批间差异小;
专属性强:特异性检测CAR或TCR基因拷贝数,不受其他外源基因组DNA干扰;
防干扰强:添加内部对照(IC),便于排除样本干扰、反应配制异常等因素。
产品信息
|
产品 |
货号 |
品名 |
规格 |
|
样本前处理 试剂盒 |
18461ES |
MolPure® Magnetic Residual DNA Sample Preparation Kit磁珠法残留DNA样本前处理试剂盒(瓶装) |
25T/100T |
|
18462ES |
MolPure® Mag32 Residual DNA Sample Preparation Kit FA磁珠法残留DNA样本前处理试剂盒FA(预封装) |
2×16T/ 6×16T |
|
|
核酸提取仪器 |
80501ES |
Auto-Pure 32A automated nucleic acid extraction system Auto-Pure 32A全自动核酸提取仪 |
32通量 |
|
qPCR检测 试剂盒 |
41313ES |
CAR/TCR Copynumber Detection Kit CAR/TCR 基因拷贝数检测试剂盒 |
50T/100T |
参考文献:
[1]中国食品药品检定研究院. CAR-T细胞治疗产品质量控制检测研究及非临床研究考虑要点[J].中国药事,2018,32(6):829-852.
[2]免疫细胞治疗产品临床试验技术指导原则(试行). 国家药品监督管理局药品审评中心, 2021.
[3]FDA.Considerations for the Development of Chimeric Antigen Receptor (CAR) T Cell Products Draft Guidance for Industry,March 2022.Docket Number:FDA-2021-D-0404.Issued by:Center for Biologics Evaluation and Research.
[4]Kunz A, Gern U, Schmitt A, et al. Optimized Assessment of qPCR-Based Vector Copy Numbers as a Safety Parameter for GMP-Grade CAR T Cells and Monitoring of Frequency in Patients. Mol Ther Methods Clin Dev. 2020 Feb 20; 17:448-454. doi: 10.1016/j.omtm.2020.02.003. PMID: 32201711; PMCID: PMC7078460.
