华西&协和研究人员都在做的分析——拟时序
作者:上海吉凯基因医学科技股份有限公司 2023-03-21T15:03 (访问量:18567)
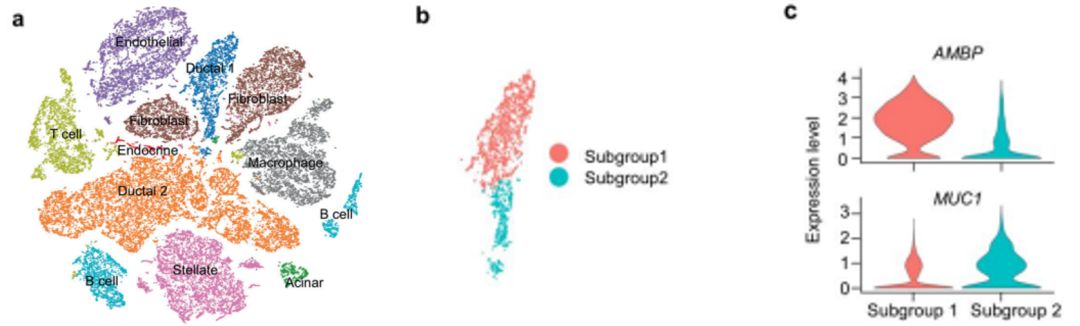
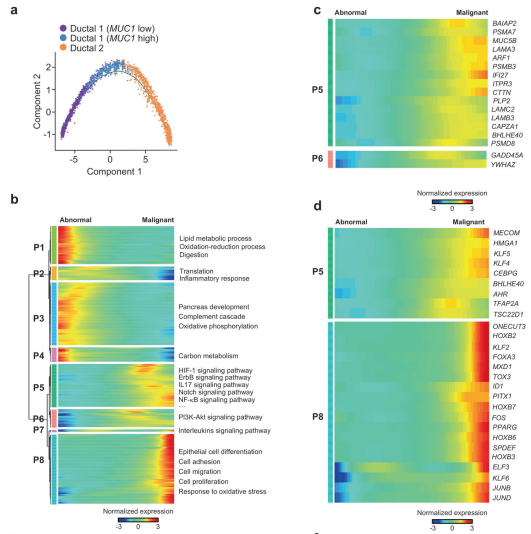
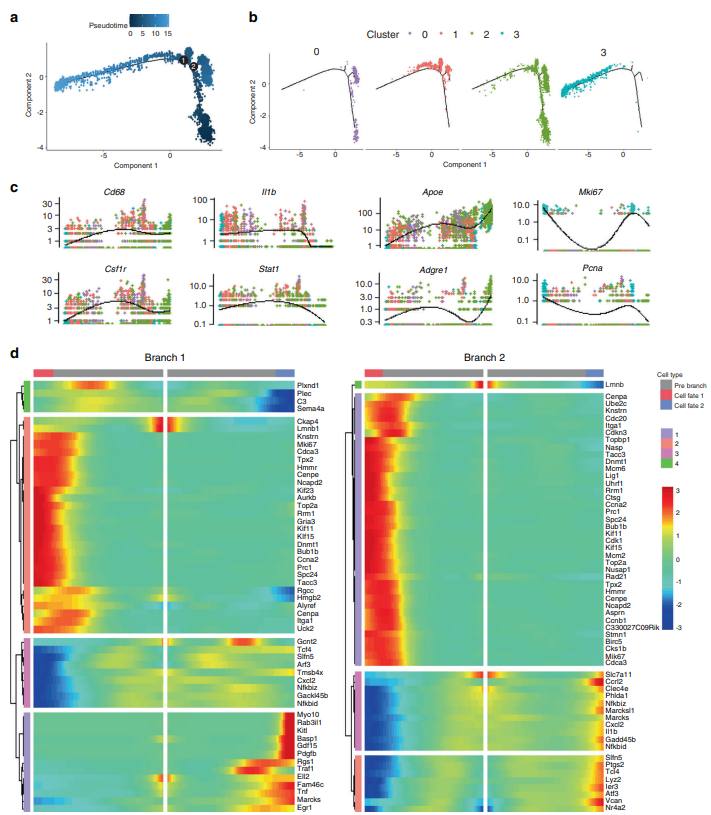
在细胞发育及分化等过程的单细胞研究中,同一时间捕获的细胞有些是分化后期的细胞,有些是分化早期的细胞。当我们想要了解在细胞从一种状态转换到另一种状态时所发生的调节更改的顺序时,我们可以进行拟时序分析(pseudotime analysis)。通过计算细胞间基因表达量的渐变关系,利用算法预测所有细胞在一条或多条虚拟的时间线上的先后顺序,构建出细胞的发育或分化轨迹。通过分析基因的表达特征,可以揭示随时间变化在发育或分化节点起关键作用的核心基因。
上海吉凯基因医学科技股份有限公司 商家主页
地 址: 上海市浦东新区张江高科技园区爱迪生路332号
联系人:
电 话: 4006210302
传 真:
Email:service@genechem.com.cn
相关咨询
IF:31.37 少吃就不会胖了......吗? (2024-02-05T00:00 浏览数:67126)
多巴胺总让人感觉愉悦?新研究发现多巴胺也引起回避行为 (2024-02-05T00:00 浏览数:55888)
高效感染造血干细胞利器——嵌合型腺病毒载体Ad5/F35 (2024-02-05T00:00 浏览数:59294)
分子灯笼,传递在黑夜中的微光 (2024-02-05T00:00 浏览数:54974)
用条形码文库病毒轻松给细胞打上条形码 (2024-02-04T00:00 浏览数:57732)
Science新作:筛选关键神经元,逆转完全性截瘫 (2024-02-04T00:00 浏览数:65081)
Nat Commun:沈阳药科大学与新加坡国立大学报道新型多价IL-15递送策略 (暂无发布时间 浏览数:54523)
猫咪是我的家人,我才不舍得给她做绝育手术呢!AAV来为您解忧 (暂无发布时间 浏览数:62257)
一闪一闪亮晶晶 选好荧光很要紧 (暂无发布时间 浏览数:69465)
【硬核】外周对中枢的神经环路示踪策略 (暂无发布时间 浏览数:68564)
ADVERTISEMENT