激光共聚焦实验的样品准备方法对比
——无需细胞爬片的样品准备新方法 VS 传统方法
激光共聚焦显微镜可以观察到细胞内已经标记好的蛋白质和分子,为生物学研究提供了更直观的观测方法。如今,激光共聚焦成像已经是一个非常常规的实验操作,应用于生物学各个研究领域中。
在细胞实验中,如果要进行一次激光共聚焦成像,除了要知道相关的显微镜参数设置和操作以外,样品的准备也是非常重要的一环。
传统方法
由于激光共聚焦实验对观测耗材的底部有着比较高的要求,普通的培养皿,培养板或者培养瓶都不能直接用于激光共聚焦成像。
1.比较常用的是使用170μm左右厚度的盖玻片作为激光共聚焦成像的细胞载体。但是使用盖玻片,在实验操作上是非常麻烦的,如果买的是国产的盖玻片,首先要做的一步是将盖玻片清洗并且烘干灭菌,才能开始使用。
2.进口的细胞爬片,虽然不需要清洗,但是还是需要进行包被才能让细胞正常贴壁生长。通常是将处理好爬片直接放在多孔板中,然后铺细胞,荧光染色后,再用镊子将爬片拿出,反过来放在滴有封片剂(甘油配置)的载玻片上,再进行成像。如图一所示:
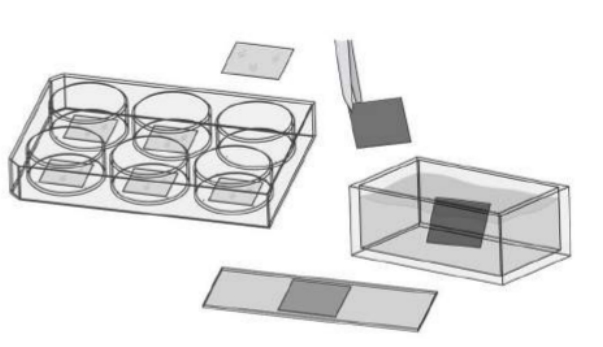
图一:使用盖玻片和细胞爬片的做免疫荧光方法示意图。
操作流程:
1.盖玻片需用浓硫酸浸泡过夜,第二天用自来水冲洗20遍,置于无水乙醇中6小时,后用三蒸水冲洗3遍,再放在饭盒或玻璃培养皿中烘干,消毒,再烘干后放入超净台备用。
2.准备好的盖玻片或者专业的细胞爬片需要根据细胞的贴壁情况使用多聚赖氨酸等蛋白包被。
3.培养板中放置爬片非常有技巧,要将爬片与培养板底部紧密贴合,这样才能避免长成双层细胞。
4.常规免疫荧光操作后,取出爬片。准备载玻片一张,在中间滴加适量的封片剂(甘油配置),将盖玻片或爬片翻过来,盖在封片剂上,再用指甲油封片进行成像。
5.在激光共聚焦成像之前,最好用荧光显微镜检查一下细胞状态和成像效果,再去做激光共聚焦,毕竟做一次激光共聚焦的成像也不便宜的。
无需爬片的新方法
这里要介绍的新方法,大大简化了样品准备流程,需要用到专为共聚焦实验设计的共聚焦培养皿,这里以德国ibidi的共聚焦培养皿为例(81156,德国ibidi)进行说明。共聚焦培养皿的底部是聚合物材质,具有亲水表面,让大多数种类的细胞都可以直接贴壁,无需另外进行包被;同时,它们的底部符合盖玻片标准——只有180µm的厚度,在折射率,阿贝系数上,它们的性能和标准爬片一致,再加上极低的自发荧光和细胞可以直接贴壁的特性,使它们成为共聚焦成像的专用培养皿。
所有的操作都在培养皿中进行,不再需要镊子以及繁琐的清洗,灭菌,包被程序(流程如图二所示)
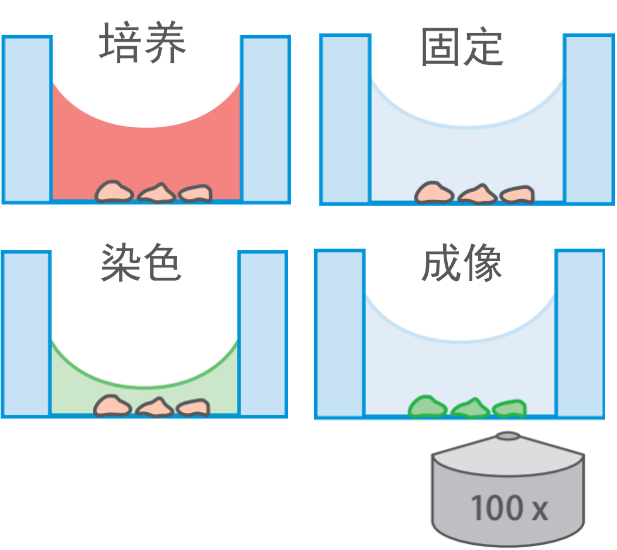
图二:共聚焦专用培养皿的准备样品流程,可以直接进行细胞培养-染色-成像操作(图中为德国ibidi 81156培养皿)
操作流程
1.在超净台中打开共聚焦专用培养皿的灭菌包装,拿出培养皿,加入细胞悬液,盖上皿盖,放入培养箱中静置,等待细胞贴壁。常规细胞培养,待细胞长置合适密度再取出,进行免疫荧光染色。
2.吸出培养基,以PBS清洗细胞,再用2%的多聚甲醛PBS溶液固定细胞。
3.20分钟后,吸出固定液,加入0.1%Triton X-100
4.10分钟后,吸出Triton,清洗细胞后加入BSA封闭。
5.加入抗体荧光染色后,吸出所有试剂,加入封片剂,可以开始共聚焦显微成像。
使用共聚焦培养皿还有个好处:往往一个共聚焦扫描成像持续时间很长,培养皿中的液体非常容易挥发,共聚焦培养皿有皿盖,可以减少挥发;比如上述提到的ibidi共聚焦培养皿,有个巧妙的锁扣设计,可以扣紧培养皿,保证在共聚焦成像的过程中,皿中的液体不会挥发(图三)。
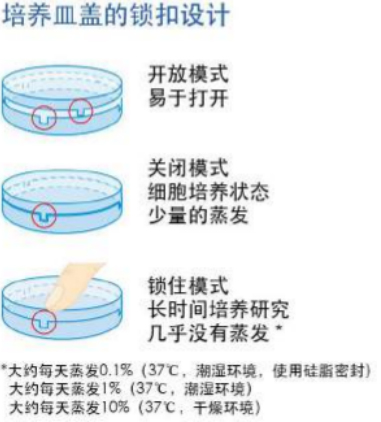
图三:ibidi共聚焦培养皿的锁扣设计
方法优势总结
1.一个培养皿完成细胞培养-染色-成像等系列操作,无需包被,无需爬片,操作简便;
2.在培养皿里的操作对于操作技术的要求相对更低,也更便捷;
3.培养皿可使用皿盖减少蒸发,杜绝挥发对成像的影响。
